
在本文中,格雷斯海姆(Gerresheimer)公司的高级医学事务经理 RezaAbedian 博士、全球市场经理 MarieStockton 以及科学事务与应用技术负责人 BerndZeiss 探讨了玻璃体内注射( IVI )的复杂性及尚未满足的临床需求,并阐释了格雷斯海姆注射器技术如何助力克服这些挑战。
通过玻璃体内注射( IVI )将蛋白类液体药物直接输送至玻璃体,改变了视网膜疾病的治疗方式。IVI 可以将精确浓度的药物直接输送到眼后段,并且最大限度地减少全身副作用¹。虽然 IVI 在临床上疗效显著,但仍面临诸多挑战,包括注射剂量的精确性和操作的可重复性、操作流程的效率不高以及患者的安全性等问题²。为此,格雷斯海姆通过深入研究与测试,开发了针对 IVI 优化的注射器技术,并持续投入创新以便更好地服务临床需求,惠及患者健康。
IVI 在视网膜疾病治疗中的核心作用
玻璃体内注射(IVIs)已成为注射抗血管内皮生长因子(anti-VEGF)药物、皮质类固醇和抗生素以治疗视网膜疾病的标准手段。这一方式对于治疗多种严重眼部疾病至关重要。湿性年龄相关性黄斑变性(AMD)是导致老年人视力丧失的主要原因之一,通过anti-VEGF治疗可抑制VEGF活性,减少新生血管形成和液体渗漏,从而稳定甚至改善许多患者的视力。同样,糖尿病性黄斑水肿、糖尿病视网膜病变和视网膜静脉阻塞等疾病也常通过玻璃体内注射来减轻黄斑水肿,恢复或维持患者的视力。随着糖尿病患者数量的增加以及大多数地区人口老龄化的加剧,玻璃体内注射(IVIs)的需求量逐年上升,对于高效且有效的 IVI 治疗的需求也随之增长。
剂量准确性:注射器与操作经验双重挑战
IVI 面临的挑战:确保剂量与注射体积的精确性以及操作的可重复性
由于玻璃体内注射体积通常为20 -100 微升(μL),因此精准且可重复的微升级别给药至关重要。其中所使用的注射器是一个关键因素,但医生的操作经验也极大影响剂量准确性³。注射过程中,推动活塞以排出气泡并完成注射器预充的操作,推注幅度是否准确也会影响最终注射的剂量。这一点在注射剂量非常小时尤其具有挑战性,因为推杆只能移动一个极小的距离。此外,传统注射器仅依赖外筒的视觉标记(如黑色环)定位剂量,进一步增加误差风险。一项评估800次注射的研究显示,使用预灌封注射器(PFS)时,22%的注射剂量偏差超过目标体积(0.05mL)的20%⁴。
患者安全与治疗效果
如前文所述,在注射小剂量药物时,精确给药是一个挑战。如果过量注射,可能会引发诸如眼内炎症、出血以及眼内压升高(IOP),也被称为术后眼压升高⁵ 等并发症。对于如湿性年龄相关性黄斑变性(AMD)等需要反复注射治疗的慢性疾病,这些风险会进一步增加。
另一方面,由于操作技术的差异,以及某些注射器存在较大的残留空间(dead space),可能导致给药剂量不足,而剂量不足可能降低治疗效果,同时也造成昂贵药物的浪费。
另一个值得关注的问题是在注射过程中微粒进入玻璃体内。这一问题在治疗需要反复注射的疾病中尤为重要,因为随着时间的推移,这些微粒可能在眼内积聚(通常被称为“飞蚊症”),并可能影响视力。因此,《美国药典》(USP <789>)和《欧洲药典》(Ph Eur 2.9.19),对微粒数量有严格的监管要求。注射时进入玻璃体的微粒主要来自润滑注射器内壁的硅油、药物处方本身、给药过程以及密封胶塞。
将药物从西林瓶转移至普通硅化注射器的过程会显著增加微粒污染的风险。而使用预灌封注射器(PFS)则能够显著降低残留体积和微粒负荷,同时大幅减少污染风险,从而降低眼内炎的发生6,7。
操作效率与临床负担
目前 IVI 的操作往往较为耗时,这在临床环境中增加了成本并加重了资源负担。如果治疗药物是以西林瓶形式储存的,则在给药前必须先将其转移至注射器中,并按照患者所需的剂量进行预充。这一过程不仅增加了人为操作失误的可能性,也降低了操作的整体效率。随着需要通过 IVI 治疗的视网膜疾病患病率不断增加,优化流程提高效率对降低医疗成本与资源消耗尤为重要。
应对 IVI 挑战的解决方案
格雷斯海姆作为全球的眼科包装解决方案提供商,致力于持续研发创新,以应对该领域尚未满足需求的解决方案。
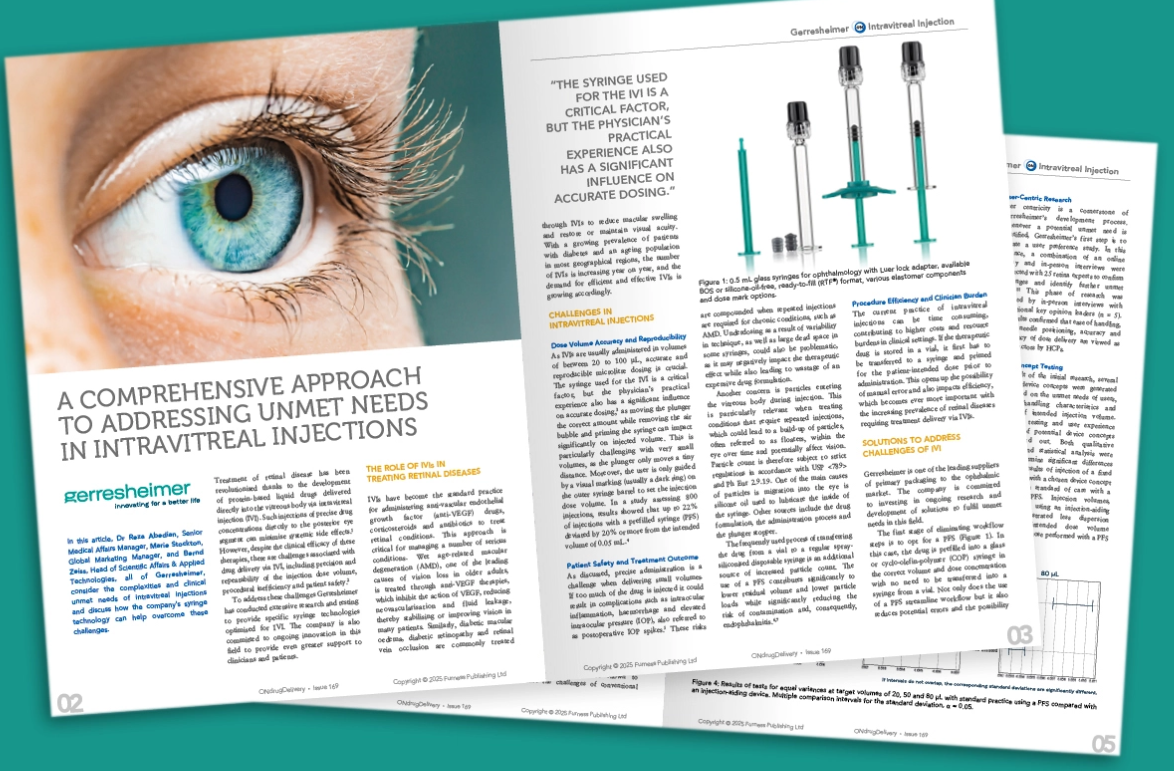
预灌封注射器(PFS)(图1)是优化注射流程的第一步。在此方式下,药物已按正确的体积和剂量浓度预先填充至玻璃或环烯烃聚合物(COP)注射器中,无需再从西林瓶转移至注射器。使用预灌封注射器不仅简化了操作流程,还能减少潜在的误差和污染的可能性。最重要的是,近期研究表明,采用预灌封注射器(PFS)进行玻璃体内注射(IVIs)可显著降低眼内炎的发生率⁷。

图 1:0.5mL玻璃注射器(含鲁尔锁接头),可选BOS烘烤硅化或无硅油设计,支持(RTF®)免洗免灭配置与多种剂量标记选项。
BOS烘烤硅化注射器
与适用于多种药物和应用的传统喷涂硅油工艺不同,只有特殊的低微粒硅化工艺(如烘烤硅化工艺,简称BOS)才能形成更薄、更均匀且更稳定的硅油层,这是因为硅油通过氢键与部分共价键结合在了表面。这大大降低了硅油在药物保质期内以及注射过程中迁移到药物中的风险,从而避免可能引起聚集、药物相互作用以及微粒迁移至玻璃体内的风险。BOS 已经证明能够满足 USP <789> 对眼科药物微粒要求。
无硅油注射器
格雷斯海姆推出的无硅油注射器标志着注射器技术的一项重大创新。这类注射器摒弃含硅润滑剂,从而避免硅油导致的微粒形成,因为硅油可能在玻璃体内注射前诱发蛋白质聚集。注射器中硅油的释放可能加剧这一过程,并导致制剂中蛋白质聚集的微粒增多⁸。因此,去除硅油有助于提高包材与敏感蛋白类药物的相容性,降低聚集风险⁹。
经验证的注射器性能
在一项评估烘烤硅化(BOS)注射器和无硅油注射器性能的研究中,发现其微粒水平显著低于《美国药典》<789>的要求,这证实了它们适用于眼科应用(图 2)。测试过程中使用了注射用水,分别对玻璃和环烯烃聚合物(COP)材质的注射器在实时和加速储存条件下进行了评估。结果显示,在所有测试条件下,微粒数量均保持在较低水平。对 BOS 和不含硅油注射器的比较分析表明,这两种选择都安全有效,并符合 USP <789> 标准要求。
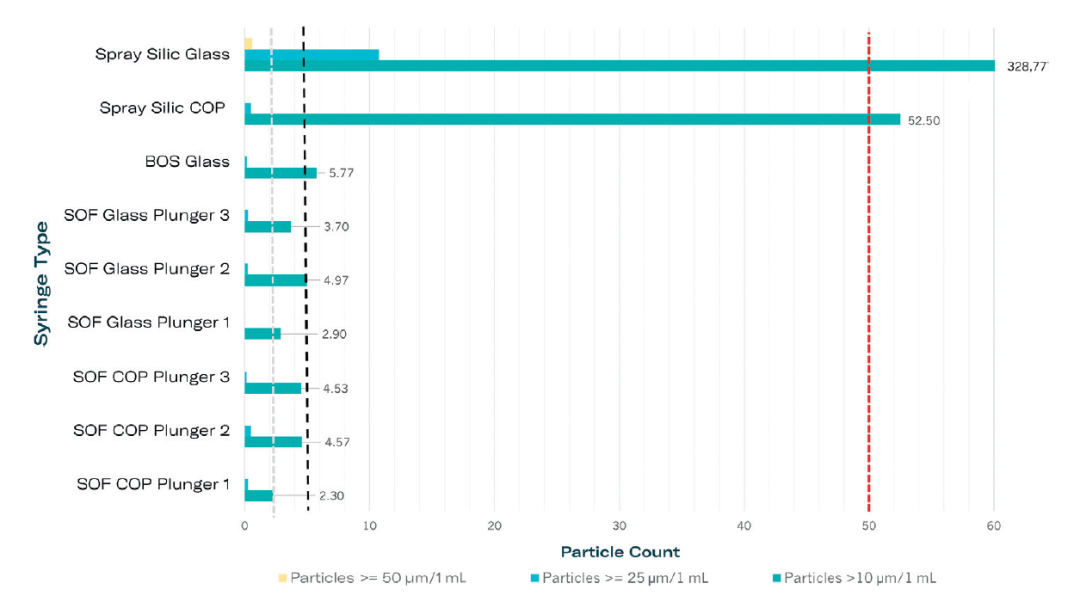
图 2:根据 USP <789> 标准,对不含硅油的 1 毫升注射器以及经过硅化处理的系统进行了微粒测量。图中虚线分别表示符合 USP <789> 标准的三类微粒限值。所有测试用注射器均填充了注射用水。具体说明如下:COP/Glass 表示注射器材料;Spray Silic 表示喷涂硅油处理;BOS 表示烘烤硅化处理,且每种材料均配备带有涂层的胶塞。此外,SOF(无硅油注射器)与胶塞1-3相关的注射器,其特征在于采用不同类型的胶塞设计。
剂量准确性
为了精确输送微升级剂量,需要使用容量为0.5 mL或1 mL的预灌封注射器(PFS),因其具有较小的内径。玻璃注射器内径公差可设定为±0.1 mm,甚至可达±0.05 mm,以满足最严苛的要求。而环烯烃聚合物(COP)注射器采用注塑成型工艺,这意味着其尺寸公差更小,从而实现更高的剂量体积准确性。
剂量标记是眼科专家在进行此类小剂量注射时的重要视觉辅助工具。这种可视剂量标记有助于准确判断胶塞的停止位置,从而实现对患者所需剂量的精确注射。格雷斯海姆在其玻璃注射器生产工厂中采用了先进的视觉检测系统,确保注射器上的剂量标记准确无误,误差范围低至± 0.25 mm。
启动力与滑动力
启动力和滑动力(BLGF)测试进一步验证了这些注射器用于玻璃体内注射(IVIs)的适用性。在经过三个月的加速老化测试(相当于实际储存三年)后,所有无硅油玻璃注射器的BLGF值均低于20 N,表明出了优异的使用性能。滑动力未受老化影响,突显该注射器系统的稳定性和可靠性(图3)。
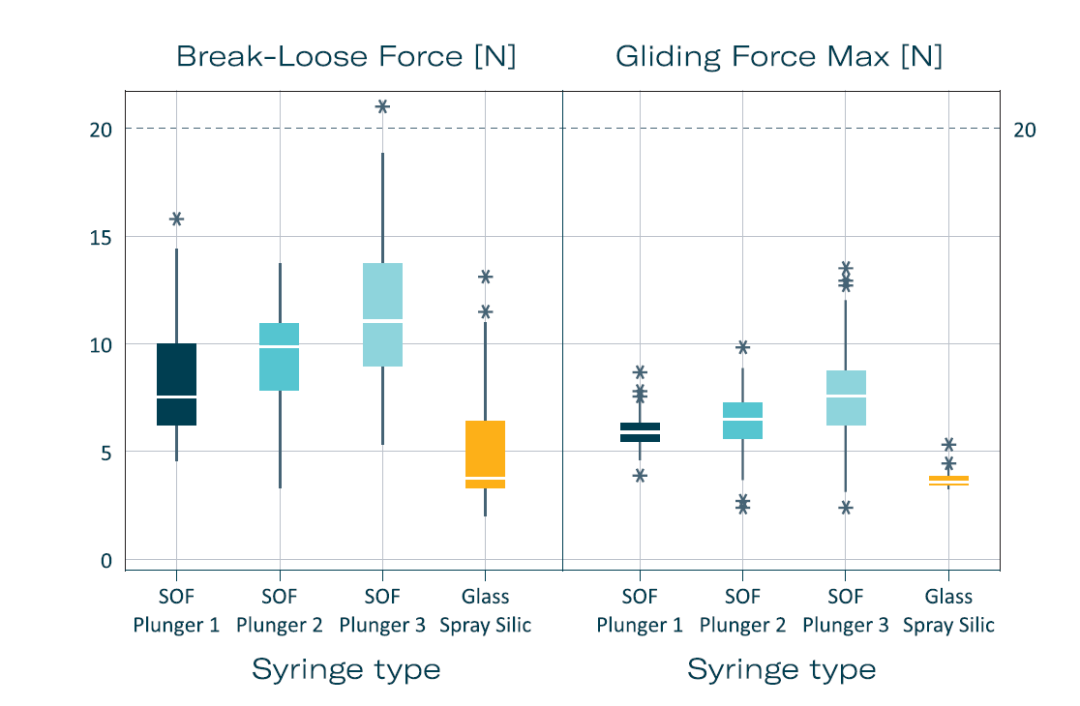
图 3:无硅油注射器与喷涂硅油注射器启动力滑动力的比较。推注速度:270 毫米/分钟。每个注射器均为 1 毫升细长,配备普通璧厚27G针头,并填充注射用水。每项测试均平行测试160次:总共 [T0(灌注后3天),T1(3个月),T1加速(根据 ICH 标准加速老化 3个月),T2加速(根据 ICH 标准加速老化 6个月),T2(6个月)]。注释:SOF with plungers 1–3:无硅油注射器,带有三种来自不同厂家的特殊胶塞;Glass Spray Sili:0.5mg喷涂硅油玻璃注射器+覆膜胶塞。
满足患者与临床医生的需求
在推动创新的同时,格雷斯海姆始终将提升患者和临床医生在玻璃体内注射过程中的体验置于首位。通过减少甚至消除硅油颗粒,并确保预灌封注射器(PFS)注射顺畅,公司提供的解决方案显著提升了患者安全性。对临床医生而言,采用预灌封注射器简化了准备工作,缩短了操作时间,同时降低了给药误差和污染风险。这不仅大幅提升了工作流程的效率,也让医护人员(HCPs)能够更专注于患者护理。
IVI 操作还能进一步优化吗?
格雷斯海姆的注射器已经大幅改善了玻璃体内注射所面临的挑战。然而,眼科专家的判断力、操作技巧和临床经验,仍会对微升级别给药的准确性、可重复性以及患者舒适度产生影响10。这些因素在处理极小剂量时尤为关键——例如,治疗早产儿视网膜病变时,注射剂量可能低至 20 μL。在此类情况下,患者的安全性和舒适性更需重点关注。此外,还需考虑药物的治疗窗口:若治疗窗口较窄,剂量过高或不足可能对治疗效果产生更大影响。因此,格雷斯海姆发起了一项创新项目,旨在开发一种辅助注射装置,以进一步优化玻璃体内注射的精准度、安全性和操作效率,更好地满足患者和医护人员的需求。
开展以用户为中心的研究
以用户为中心是格雷斯海姆开发流程的核心理念。每当发现潜在的未被满足的需求时,公司首先会开展用户偏好研究。在本案例中,通过在线问卷与面对面访谈相结合的方式,对25位视网膜专家进行深入调研,旨在确认临床实践中的挑战并挖掘更多未被满足的需求11。随后,研究团队还对五位国际权威意见领袖(KOLs)进行了深度访谈。研究结果表明,操作便捷性、针头定位的精确性,以及给药剂量的准确性与一致性,被医护人员视为关键因素。
初步概念测试
基于初步研究,团队提出了多个设想的装置概念,重点聚焦于用户尚未被满足的需求,例如操作特性以及预定注射剂量的准确性。随后,对这些装置概念进行了验证测试和用户体验验证。采用定性评估与统计分析相结合的方法,确定使用辅助装置的预灌封注射器注射与手动注射进行常规治疗的结果是否存在显著差异。结果显示,与手动注射相比,装置辅助注射减少了输送量的可变性,剂量一致性显著优于手动操作(图4)。

图4:注射20、50和80μL样本使用辅助装置的预灌封注射器注射与手动注射的方差相等性检验的结果。标准差的多重比较区间,α = 0.05。
原型装置的深度测试
随后,成功研制出注射辅助装置的升级版原型,并对其在20、50和80 μL目标剂量下的注射准确性与重复性进行严格测试。五名使用者分别使用带有注射辅助装置原型的预灌封注射器(PFS),以及采用视觉剂量标记的预灌封注射器作为当前IVI 的标准操作方法,对每个目标剂量体积进行了注射(每位使用者对每个目标剂量注射10次)(图5)。

图 5:注射20、50和80μL样本使用辅助装置的预灌封注射器注射与手动注射的剂量分布直方图。
结果表明,使用该注射装置时,注射量的波动性比手动注射时要小。统计分析证实,借助辅助装置的注射具有更优的一致性。该设备的潜在优势是多方面的:通过改进注射过程中的关键环节,注射辅助装置可通过减少剂量误差来提高患者安全性,同时还有望缩短操作时间,使患者和临床医生双双受益。
格雷斯海姆致力于与该领域专家紧密合作,以确保最终产品符合最高的安全性和有效性标准12。未来开发步骤包括进一步测试,以优化装置设计并验证其在实际环境中的性能表现。该研究项目目前仍在进行中,下一阶段的研究成果也已获采纳。
结论
IVI 是眼科十分重要的治疗手段,但在确保给药的精确性、安全性和高效性方面仍面临挑战,尤其是在要求较高的视网膜疾病治疗中。格雷斯海姆(Gerresheimer)始终致力于以患者和用户为中心的创新,不断识别并满足尚未解决的需求。通过这一方式,公司始终走在玻璃体内药物递送解决方案的前沿,助力医疗专业人员,为患者实现最佳治疗效果。
文献
1. Angermann R et al, “Changes in systemic levels of vascular endothelial growth factor after intravitreal injection of aflibercept or brolucizumab for neovascular age-related macular degeneration”. Retina, 2022, Vol 42(3), pp 503–510.
2. Agra LM et al, “Accuracy, Precision, and Residual Volume of Commonly Used Syringes for Intravitreal Injections and the Impact on Intraocular Pressure”. Ophthalmol Retina, 2023, Vol 7(10), pp 892–900.
3. Meyer CH et al, “Routes for Drug Delivery to the Eye and Retina: Intravitreal Injections”. Dev Ophthalmol, 2016, Vol 55, pp 63–70.
4. Raju JR and Weinberg DV, “Accuracy and precision of intraocular injection volume”. Am J Ophthalmol, 2002, Vol 133(4), pp 564–566.
5. Dounce S et al, “Particulate Matter from Syringes Used for Intravitreal Injections”. Retina, 2020, Vol 41(4), pp 827–833.
6. Levin AM et al, “Intraocular Pressure Elevation Following Intravitreal Anti-VEGF Injections: Short- and Long-term Considerations”. J Glaucoma, 2021, Vol 30 (12), pp 1019–1026.
7. Louis AM et al, “Impact of Prefilled Syringes and Masking on Postintravitreal Injection Endophthalmitis”. J Vitreoretin Dis, 2023, Vol 7(5), pp 382–388.
8. Melo GB, “Potential Implications of Silicone Oil From Syringes.” Retinal Physician, 2022, Vol 19, pp 40–42.
9. Schargus M et al, “Contamination of anti-VEGF drugs for intravitreal injection: How do repackaging and newly developed syringes affect the amount of silicone oil droplets and protein aggregates?” Retina, 2018, Vol 38(10), pp 2088–2095.
10. Shetty G, Zeiss B, “Microlitre Dosing with Prefillable Syringes – When Does a Device Make Sense?”, ONdrugDelivery, Issue 97 (May 2019), pp 28–31.
11. Abedian R et al, “Facilitating microliter dosing for intravitreal application: A User-Preference Study”. Gerresheimer, Oct 2023.
12. Abedian R et al, “A User-preference Study on an Ophthalmic Injection Device to Facilitate Microliter Dosing for Intravitreal Injections”, Proceedings of PDA Universe of PFS and Injection devices, Oct 2024.






